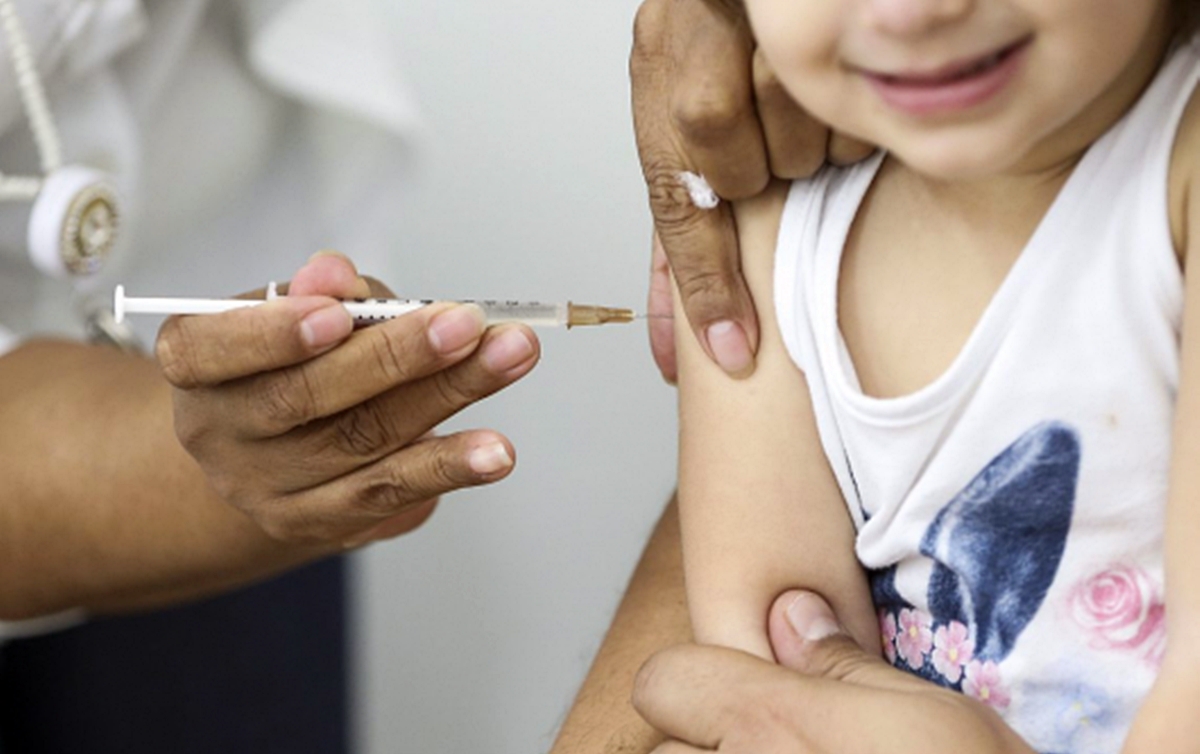

A Pfizer anunciou nesta segunda-feira (20) que um ensaio de fase 2 revelou que sua vacina contra a Covid-19 é segura e gerou uma resposta “robusta” de anticorpos em crianças de 5 a 11 anos.
Estes são os primeiros resultados divulgados para esta faixa etária para uma vacina contra a Covid-19 dos Estados Unidos – no entanto, os dados ainda não foram revisados por pares.
A Pfizer disse que planeja submeter os dados compilados para esta faixa etária à FDA (Food and Drug Administration) dos EUA para autorização de uso emergencial em breve.
O ensaio incluiu 2.268 participantes com idades entre 5 e 11 anos e usou um regime de duas doses da vacina administrada com 21 dias de intervalo.
Estes testes usaram uma dose de 10 microgramas – menor do que a dose de 30 microgramas que foi usada para pessoas com 12 anos ou mais.
“A dose de 10 microgramas foi cuidadosamente selecionada como a dose preferida para segurança, tolerabilidade e imunogenicidade em crianças de 5 a 11 anos de idade”, disse a farmacêutica Pfizer.
As respostas imunológicas dos participantes foram medidas observando-se os níveis de anticorpos neutralizantes no sangue e comparando-os a um grupo de controle de 16 a 25 anos de idade que recebeu um regime de duas doses – com a dose maior de 30 microgramas.
A Pfizer disse que os níveis se comparam bem aos de pessoas mais velhas que receberam a dose maior, demonstrando uma “forte resposta imunológica neste grupo de crianças um mês após a segunda dose”.
“Além disso, a vacina foi bem tolerada, com efeitos colaterais geralmente comparáveis os observados em participantes de 16 a 25 anos de idade”, disse a empresa.
Um porta-voz da Pfizer também confirmou que não houve casos de miocardite, um tipo de inflamação do coração que tem sido associada a vacinas de mRNA.
Pedido de aprovação na FDA
A Pfizer disse que esses dados serão incluídos em uma “submissão de curto prazo” para os EUA e as empresas continuarão a acumular os dados necessários para solicitar a aprovação do FDA para a faixa etária de 5 a 11 anos.
A vacina da Pfizer está atualmente aprovada para pessoas com 16 anos ou mais e autorizada para uso em pessoas com 12 a 15 anos.
A Pfizer disse que espera dados de testes para crianças a partir dos 6 meses “já no quarto trimestre deste ano.”
A comissária em exercício da FDA, Dra. Janet Woodcock, e o Dr. Peter Marks, diretor do Centro de Pesquisa e Avaliação Biológica da FDA, disseram em um comunicado neste mês que a agência revisaria os dados de uma vacina para crianças “o mais rápido possível, provavelmente em um questão de semanas em vez de meses “, uma vez que os dados tenham sido submetidos para autorização.
“No entanto, a capacidade da agência de revisar esses pedidos rapidamente dependerá em parte da qualidade e do prazo dos fabricantes”, escreveram eles.
Com informações da CNN
WHATS 98 FM
Quer receber notícias na palma da sua mão? É muito fácil. Para ficar bem informado, mande um “oi” agora mesmo para o nosso WhatsApp e fique atualizado.
Fale conosco: 99998-9898
